本学以外の倫理審査委員会や認定臨床研究審査委員会で審査された研究を実施する場合、あるいは、試料・情報の提供のみを行う場合は、機関長の許可を得る必要があります。
許可申請は以下のフォームから申請してください。
機関長の研究実施許可通知の受領後(臨床研究法の場合は機関長の許可取得かつjRCT で実施計画の公開後)に研究を開始してください。
他機関で審査を受ける前の準備
1.適用規制を確認する
以下の確認ポイントで、適用している規制を確認してください。
| 確認ポイント | 人を対象とする 生命科学・医学系研究に関する倫理指針 | 臨床研究法 | |
|---|---|---|---|
| 審査する委員会名称 | 倫理審査委員会、研究倫理審査委員会 など | 認定臨床研究審査委員会 | |
| 申請書式 | 利益相反申告書 | 本学の利益相反申告システムを利用 | Excelの様式A~Eを利用 |
| 審査結果通知書 | 委員会独自の書式 | 統一書式4 | |
| 研究計画書の記載 | 『「人を対象とする生命科学・医学系研究に関する倫理指針」に則り実施』と明記されている | 『「臨床研究法」に則り実施』と 明記されている | |
2.倫理指針が適用される研究の場合は委員会を確認する
審査を受ける予定の外部委員会が本学が認めている委員会であることを確認してください。本学が認めていない委員会の場合は、本学の倫理審査委員会で個別審査を受けてください。
本学が認める外部の委員会
3.書類を提出する
研究代表機関(指針)または、統括管理者(法)から求められた書類を作成し、主幹に提出してください。
- 教育受講
- 利益相反資料
【倫理指針】
利益相反Web申告システム から申請・入手。
入力マニュアルはこちら(学内専用)からご確認ください。
【臨床研究法】
メールで申請・入手
(医学研究監理室 E-mail:hqcoi[a]belle.shiga-med.ac.jp ※[a]を@に変えて送信してください)
- 研究機関要件確認書(記載例(学内専用)) など
他機関で承認された研究の機関長の許可取得
主幹から【機関長の許可申請に必要な申請書類】を入手し、申請フォームより提出してください(メールでは受付けていません)。
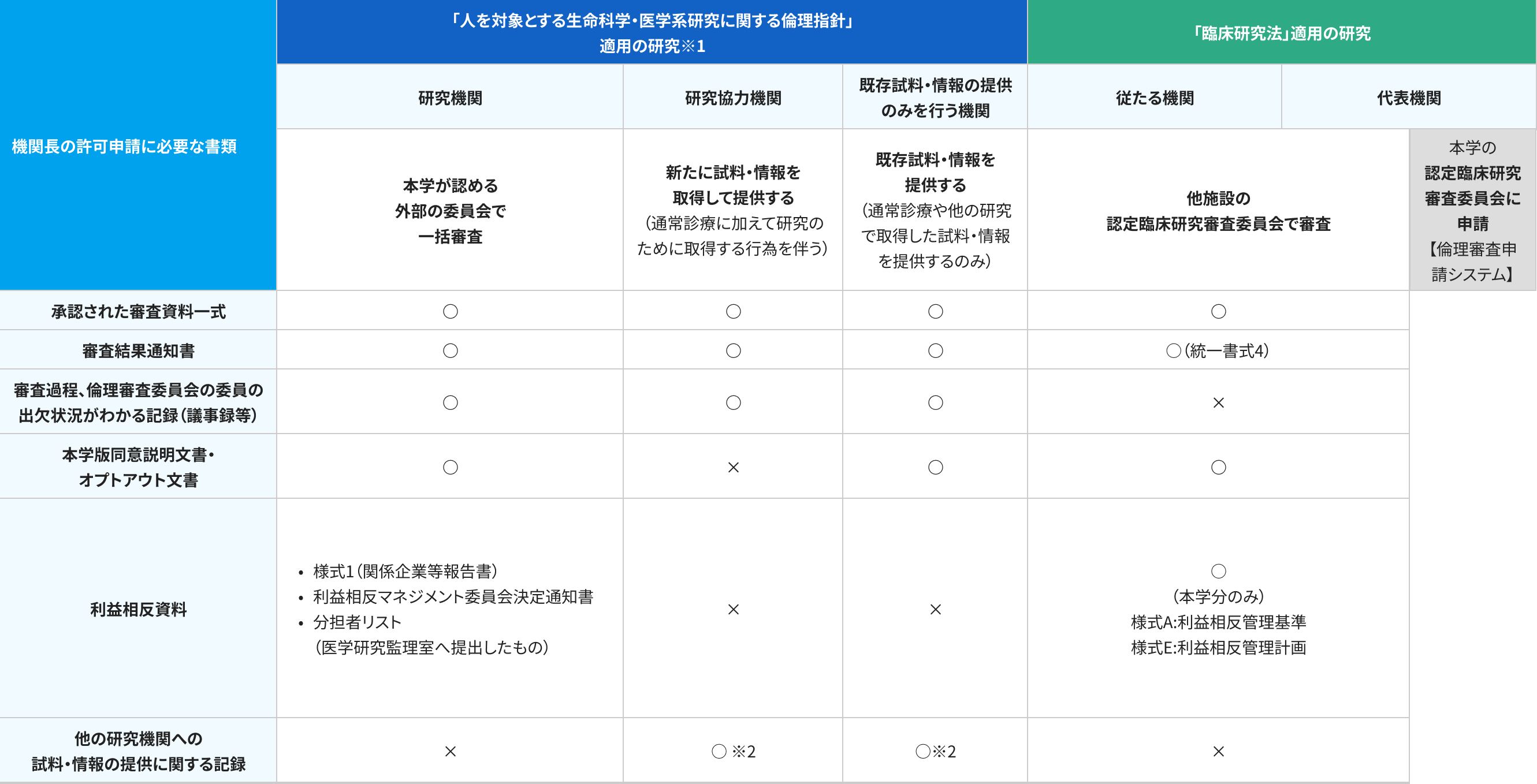
※1 「研究機関」「研究協力機関」「既存試料・情報の提供機関」の役割についてはこちら
※2 指定された様式がない場合は、指針ガイダンス参考様式(厚労省):記載例を用いて作成してください。
研究開始後に倫理審査に関する連絡を受けた場合の申請・報告
研究代表者または統括管理者から提供された審査資料一式を添えて、速やかに機関長の許可申請・報告をしてください。
申請・報告は、申請フォーム からお願いします。(○:申請必要 ✖:申請不要)
| 通知内容 | 倫理指針適用の研究 | 臨床研究法適用の研究 |
|---|---|---|
| 変更申請 | ○ | ○ |
| 軽微変更・届出外変更 | – | ×機関長への報告不要 |
| 安全性情報 | ○重篤な有害事象報告 | ○医薬品疾病等報告 |
| 不具合報告 | – | ○医療機器疾病等又は不具合報告 |
| 不適合報告 | ○ | ○ |
| 定期報告 | ○ | ○ |
| 終了・中止報告 | ○ | ○ |
本学で重篤な有害事象/疾病・不具合・不適合が発生した場合の報告
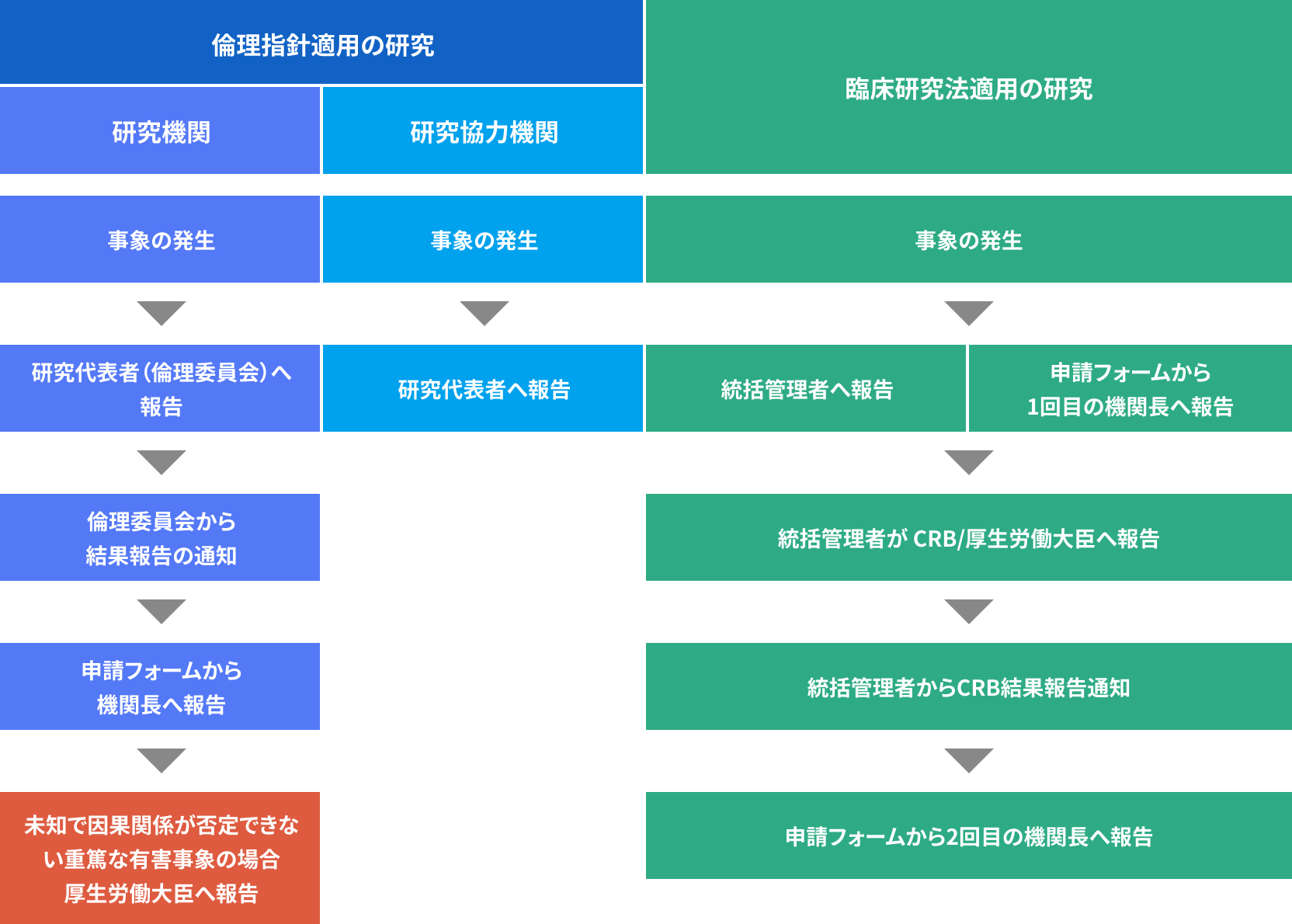
手順書
- 他機関審査 臨床研究の管理に関する手順書_EC0001 第2版
- 機関の長の許可・報告に関する手順書(法)_EC0002 第2版
- 機関の長の許可・報告に関する手順書(指針)_EC0003 第3版
- 機関の長の許可・報告に関する手順書(試料・情報の提供)_EC0004 第1版
【連絡先】
臨床研究管理部門:内線 3618
Mail: Kyokadri[a]belle.shiga-med.ac.jp ([a]を@に変えて送信してください)






